Optimising Medications for Patients With Cancer and Multimorbidity: The Case for Deprescribing
Clin Oncol. 2020 Sep;32(9):609-617.
PMID: 32563549 DOI: 10.1016 / j.clon.2020.05.015
最近,週刊医学界新聞のことをブログに紹介していませんでした。
おかげさまで,第9回まで公開されています。
第1回は4月13日,ちょうど新人がやってくる時期からの連載デビューでした。
[第1回] マルモの診かた総論(前編)2020.04.13
[第2回] マルモの診かた総論(後編)2020.05.18
[第3回] 行動変容に行動科学と中動態を活かす2020.06.08
[第4回] 誤嚥性肺炎(前編)「マルモのプロブレムリスト」の作り方 2020.07.13
[第5回] 誤嚥性肺炎(後編)バランスモデルの四則演算 2020.08.10
全5回でマルモについて,情報収集モデル,バランスモデル,プロブレムリスト,ポリファーマシーリスト,四則演算などマルモへのアプローチの方法を紹介しました。
そして第2部はマルモパターンの紹介でした。
[第6回] 神経/精神科疾患パターン パーキンソン病を軸にしたアプローチ2020.09.14
[第7回] 心血管/腎/代謝パターン 心不全を軸にしたアプローチ 2020.10.12
[第8回] 骨格/関節/消化器パターン 変形性膝関節症を軸にしたアプローチ 2020.11.09
[第9回] 呼吸器/皮膚パターン 気管支喘息を軸にしたアプローチ 2020.12.07
そして次回は,
[第10回] 悪性腫瘍/消化器/泌尿器パターン 悪性腫瘍を軸にしたアプローチ
となり,これでマルモパターンの紹介が終了します。
まだまだ続きますので,お楽しみに。
ちなみに,これ1本書くのに論文を100本近く読んでいるので,おそらく1000本ぐらいこの連載のために論文を読んでいることになります。人間1000本論文を読むとその業界のことをあれこれ言えると思われるかもしれませんが,まったくそんなことはございません。むしろ,画期的なアプローチはまだ無いということに気付かされます。
さて,そんな奥の深いマルモですが,以前このような論文を紹介しました。
執筆の時に自分の過去のブログを参考にすることはよくありますが,Clinical Oncologyの2020年9月は面白い論文が多く,がんのマルモ関連だけでもここ最近非常に多いのでネタに事欠かなかったのですが,これはしっかり読んだほうが良いと思い紹介致します。(ちなみに,この論文は連載では出てこないです。もっとメッセージ性の高い内容になっていますのでお楽しみに。)
がん患者およびMultimorbidityに対する薬物療法の最適化:Deprescribingのケース
さっそくの余談ですが
Deprescribing(デプレスクライミング)ってご存知ですか?
高齢者の安全な薬物療法ガイドラインを用いたdeprescribing の実践と患者のQOL及びADLの変化という論文が非常に参考になります。
https://www.jstage.jst.go.jp/article/yakushi/137/5/137_16-00263/_pdf
これは,高齢者の安全な薬物療法ガイドラインdeprescribing の意思決定支援ツー ルとして有用であると考えられた研究です。
Deprescribing はScottらが2015 年に提唱した,薬物を減量あるいは中止するプロセスです。多剤併用に対する人々の関心を高め,処方の漫然化を解消する上でDeprescribingの用語及び概念の登場は有用と考えられました。
なお,ポリファーマシーで抑えておきたい論文は
Beers criteria という潜在的に不適切な薬剤potentially inappropriate medications(PIMs)を抽出するための方法だったり
欧州で繁用されている STOPP/START criteria
の2つですが,これらの基準は使用薬剤の違いから日本の薬物療法の現状を反映したものではないため,日本老年医学会が2015 年に「高齢者の安全な薬物療法ガイドライン」を改訂しました。
https://www.jpn-geriat-soc.or.jp/info/topics/pdf/20170808_01.pdf
このガイドラインは,エビデンスが不十分な薬剤もコンセンサスとして取り上げたこと,「特に慎重な投与を要する薬物のリスト」と「開始を考慮すべき薬物のリスト」の 2 つの薬物リストを作成したことが特徴です。漢方薬や糖尿病薬が詳細になっています。
なお,Deprescribingのプロセスは
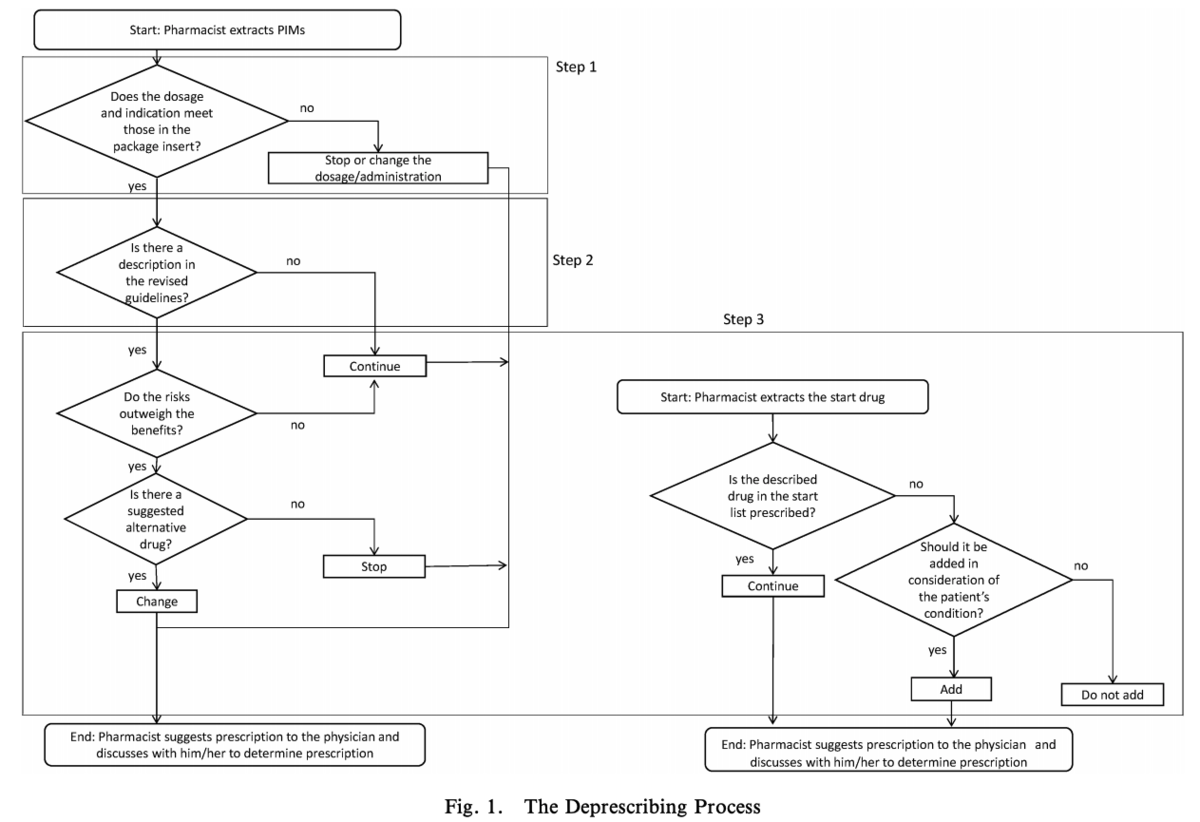
Step 1:医療用医薬品添付文書の適応症,用法・用量等に一致しない薬剤の抽出と
提案
Step 2:「改訂ガイドライン」に記載のある処方薬の抽出
Step 3:患者状態を考慮した PIMs 及び開始を考慮すべき薬剤(以下,「スタート薬剤」)の決定Step 1〜3 の結果を基に,処方変更提案リストを作成し,医師に提案する
この研究ではPIMs の中で最も多かったのはエチゾラム錠の中止,酸化マグネシウム錠,センノサイド錠及びセンナ・センナジツ顆粒から麻子仁丸への変更。次に多かったのは,抑肝散から抑肝散加陳皮半夏への変更でした。
これだけでも読み応えがありますが,これはあくまで雑談でした。
抄録
がんと診断された患者のMultimorbidityは65歳以上の高齢者であり、がんに加えて2つ以上の慢性疾患を有しており、慢性疾患のリスクはがん後にさらに高まる。がんの診断によって患者のケアの目標や治療の焦点が変化するため、Multimorbidityの存在はケアに複雑さを加える。Multimorbidityはしばしば、多剤併用、不適切な可能性のある薬物の使用、副作用の存在、薬物-薬物相互作用の可能性と関連しており、これらはすべて健康の転帰およびケアのコストに影響を及ぼす。したがって、がん患者の投薬レジメンを定期的に見直し、有益性と有害性を許容できるレベルで最適なバランスを維持できるようにするために、体系的なアプローチをとることが極めて重要である。薬物療法の見直しとDeprescribingのプロセスを導くための患者および臨床医のリソースがいくつか紹介されている。
ハイライト
- 高齢者のがん患者では、Multimorbidityがポリファーマシーのリスクを高める。
- ポリファーマシーは有害事象や予後不良を引き起こしやすい。
- Deprescribingは、がん治療中の薬物療法を最適化することができる。
- Deprescribingは転帰を改善し、ケアのコストを削減する可能性がある。
- 患者中心の処方を支援するためのツールが利用可能である。
序章
成人がん患者のほとんどは、がん診断時に追加の慢性疾患を有しており、これは先進国における慢性疾患の有病率の高さ、がんと他の慢性疾患の共通の危険因子、および両方に関連する高齢化を反映している。米国のデータによると、65歳以上のがん患者の90%以上が少なくとも1つの他の慢性疾患を有していることが示されている[ 1 ]。薬物療法はほとんどの併存疾患に対する最も一般的な治療法であるため、Multimorbidityの患者はポリファーマシー(複数の薬)にさらされている [ 2 , 3 ]。
Multimorbidityを有する患者では、個々の疾患に対する臨床ガイドラインに従って複数の薬物を使用することが、患者の転帰を改善することにつながる可能性がある。しかしながら、ポリファーマシーは、患者が潜在的に不適切な薬物(PIM)を処方されたり(4)、薬物-薬物相互作用を経験したり(5)、有害薬物イベント(ADE)を発症したり(6)するリスクを増大させる。がんの診断は、さらに別のレベルの複雑さをもたらす。初期症状を緩和するために薬剤が処方されるため、がん診断前の数ヵ月間に患者の投薬数が増加することが多い [ 7 ];化学療法および支持薬は、服用される薬剤の総数を増加させる。さらに、共存する疾患に対して複数の薬物療法を受けている患者は、抗がん剤へのコンプライアンスが低いことが多く、相互作用や副作用の可能性があるため、より効果の低い抗がん剤治療を選択することがある [ 8 , 9 ]。がんの診断により、慢性疾患のケアの目標が変わることがある。予防的な薬物療法からQOL(生活の質)に焦点が移ることもある [ 10 , 11 ] 。しかし、がん専門医は、がんに特異的でない薬剤を合理化することが困難な場合がある [ 12 ]。
投薬の適切性を評価し、再処方を支援するために、臨床医を支援するためのさまざまなツールが開発されてきた。しかし、これらのツールのほとんどは、がん領域以外で開発されたものである [ 13 , 14 ]。この論文の目的は、Multimorbidity、ポリファーマシー、PIM、ADE、およびMultimorbidityおよびがん患者における潜在的な薬物-薬物相互作用(PDDI)を管理するためのガイダンスを提供することである。患者中心のDeprescribingへのアプローチが、患者と臨床家のツールとともに紹介されている。
がん患者の併存疾患への対応
がんと診断された患者のほとんどが65歳以上であるため、がんの併存疾患を考慮することは特に重要であり、この年齢層ではMultimorbidityが一般的である[ 15 ]。がん患者は、がんでない人に比べて1つ以上の長期的な状態で生活している可能性が31%高い [ 16 ]。併存疾患は治療毒性およびがん関連の罹患率および死亡率のリスクを高め、併存疾患自体ががんとは無関係に罹患率および死亡率の競合リスクをもたらす [ 17 ]。併存疾患の存在は治療の意思決定に大きく影響し、リスク層別化に重要であり、長期的ながん転帰に影響する。心臓および肺疾患、糖尿病、および腎臓病は、高齢のがん患者において最もよく併存する疾患の1つである [ 18 ]。併存疾患とがん患者は、過剰治療と過少治療の両方のリスクがあり、このような患者に最適化された個別のケアプランを開発することが複雑な課題であることを強調している [ 19 ]。
がん患者のMultimorbidityを治療する際には、いくつかの要因を考慮しなければならない。第一に、臨床ガイドラインに従った併存疾患の治療は、ポリファーマシーや、実現可能性がなく、複雑すぎて患者中心ではない管理計画を助長している[ 20 ]。疾患治療およびがん治療に関する多くのガイドラインは単一疾患に焦点を当てており、他の疾患およびその治療が転帰に及ぼす影響を考慮していない。がんにおけるこの問題をさらに複雑にしているのは、がんの臨床試験にそのような患者が含まれていないために、高齢患者や重大な併存疾患を有する患者における最適な治療についての不確実性である。とはいえ、多くの一般的な慢性疾患では、コントロールを達成したり、有害な転帰を回避したりするために複数の薬剤を使用する必要があるため、ポリファーマシーが必ずしも不適切であるわけではない。その結果、ポリファーマシーは「適切な」タイプと「問題のある」タイプの2つの異なるタイプとして認識されるようになってきている[ 21,22,23 ]。
適切なポリファーマシーとは、薬物使用が最適化され、最良のエビデンスに基づいて薬が処方されている状況で、複雑な状態または複数の状態の個人に対して処方することと定義されています。
問題のあるポリファーマシーとは、複数の薬を不適切に処方すること、または薬の意図した効果が実現されないことと定義されています。
がん患者における重要な考慮事項は、がん治療が治療選択の結果、既存の病状の悪化または新たな病状の発生に影響を及ぼす可能性があることである。よく知られている例としては、アントラサイクリン療法を受けている患者における心疾患の併存、および免疫療法の内分泌系への影響などがある。したがって、治療選択に影響を及ぼす可能性のある短期および長期の合併症を予測するためには、がん診断時に共存疾患の種類および負担を合理的に正確に推定することが極めて重要である。
有害なポリファーマシーを回避する治療計画を考案するには、併存疾患の数と重症度、および機能状態と身体機能への影響を慎重に考慮する必要がある。負担が大きい併存疾患は、がん治療を複雑にしたり、がん治療に悪影響を及ぼす可能性が高い [ 18 ]。QOLの低下、機能的状態の低下または虚弱に関連する複数の併存疾患を有する患者では、がんの存在下での併存疾患の最適な治療には、ケアの目標および患者および家族の好みに応じて治療の数および強度を減らす適応した治療計画が必要となる。
がん治療後の慢性的な状態
がん患者は、一般集団と同じようにMultimorbidityの負担を負うだけでなく、がんのない対照群に比べて、併存疾患を発症して死亡する可能性がさらに高い。がん、その治療、および新たな慢性疾患のリスクとの間には相互作用があるようであり、その結果、がん治療後の慢性疾患の有病率が高くなり、がん治療後の既存の慢性疾患の重症度が高くなる [ 24,25,26 ]。慢性疾患はがん治療の急性期に発症することがある;例えば、チロシンキナーゼ阻害薬や免疫療法などの新規治療法は、吐き気や脱毛症などの従来の副作用よりも、心血管疾患や内分泌疾患を引き起こす可能性が高い。また、慢性疾患は、がん治療が中止された後に、がん治療の効果とその状態への影響が気づかずに管理されずに後年になって発症することもある。
がん後の慢性疾患のリスクが高くなるのは、治療そのものの効果によるもの、あるいは、潜在的にはがんと慢性疾患に共通するリスク因子の相互作用によるものである可能性がある。このような相互作用のメカニズムについてはほとんど知られておらず、この問題に関する研究のアプローチは不完全で断片的である。例えば、がん後の心血管疾患に関する研究は、主に抗がん剤の心毒性に焦点を当てており、がん前の心血管危険因子の管理とその転帰への影響についてはあまり注目されていない[ 27 ]。この分野の基礎研究および前臨床研究は、介入、医療サービス、アウトカム研究から切り離されていることが多い。
さらに、現在の医療システムは、がん管理に焦点を当てた単一疾患、プライマリケアとのケアの統合が限られていること、がん医療提供者の慢性疾患管理能力の欠如、および最良のケア提供を支援するための臨床実践ツールの欠如により、がんの併存疾患を管理するための装備が不十分である。Multimorbidityに関しては、がんケアは他の慢性疾患に比べて遅れをとっている。がん患者と医療提供者は、乳がん高齢女性の心血管疾患のように、がん以外の死亡率ががん特有の死亡率を上回るものもあるにもかかわらず、慢性疾患よりもがん特有の問題を優先する傾向がある [ 29 ]。
Multimorbidityががんの転帰に及ぼす影響に関するデータは定期的に収集されておらず、その管理を裏付ける証拠は限られている。しかし、がんと共存する疾患のインターフェースに焦点を当てることは、現在「目に見えない」問題に対処するだけではなく、潜在的な相乗効果を活用する機会でもある。それはまた、潜在的な相乗効果を活用する機会でもある。すなわち、医療提供者との相互作用が複数の問題に対処する可能性のあるケア統合や、がんの再発およびそれに続く慢性疾患のリスクを低減する可能性のある二次予防などである。
ポリファーマシー
ポリファーマシーとは、個人による複数の薬の同時使用を指す [ 21 ]。ポリファーマシーに関するシステマティックレビューでは138の定義が見つかり、大多数(80%)が数値のみの定義を報告している。最も一般的な定義は、5種類以上の薬を毎日使用することであった [ 30 ]。しかし、ポリファーマシーを定義するために薬の絶対数を使用することは、特定の状況下での複数の薬の適切性を考慮していない可能性がある。
ポリファーマシーはがんの高齢者において非常に有病率が高く、ポリファーマシーの定義に応じて11~96%との報告がある [ 31 ] 。がん生存者におけるポリファーマシーのパターンに関する大規模な集団ベースの研究では、がん生存者(64%)のポリファーマシー有病率が、がんのない成人(52%)と比較して高いことが明らかになった [ 32 ]。別の研究では、がん生存者は、がん歴のない人(13%)よりもポリファーマシーの有病率が高い(34%)ことが報告されている [ 33 ]。これらの研究は、がん生存者ががん歴のない人よりも高い薬物負担を経験しているという説得力のある証拠を提供している。
多くの状況において、ポリファーマシーは治療上有益である可能性がある [ 21 ]。しかし、それは、ADE [34 ]、薬物-薬物相互作用の増加 [35 ]、処方ミス [36 ]、薬物不服従 [37 ]、薬物の無駄遣い [21 ] と、転倒 [6 ]、虚弱者 [4 ]、計画外の入院 [38 ] と死亡率 [39 ] を含む負の健康結果を含む多くの有害な結果と関連しています。
卵巣がんを対象とした3件の第IIIII相研究のメタアナリシスでは、ポリファーマシーは全生存期間ではなく、グレード3および4の全毒性の増加と関連していることが明らかになった[ 40 ]。興味深いことに、別の研究では、ポリファーマシーと化学療法毒性の増加との関連は認められなかったが、むしろ、化学療法を開始した65歳以上の患者500人において、入院や化学療法の早期中止など、ポリファーマシーに関連した臨床的に関連する有害事象が報告されている[ 41 ]。
不適切な可能性のある薬
不適切処方は、「同じ状態を治療するために、同等またはそれ以上に有効だがリスクの低い代替療法が利用可能であるという証拠があるにもかかわらず、薬物関連の有害事象の重大なリスクをもたらす医薬品を使用すること」と説明されている[ 42 ]。PIMを「不必要」(生存、QOLまたは症状コントロールに関して患者に短期的な利益が期待できない場合)または「重複」(同じ薬理学的クラスからの2種類以上の薬)に分類している者もいる[ 43 ]。
緩和および終末期におけるPIMの有病率は22~95%である [ 43 , 44 ]。高齢のがん成人では、PIMの発生率は41~52%である [ 45 , 46 ]。転移性がんの診断後も、慢性疾患の一次予防および二次予防のために多くの人が投薬を受け続けている [ 47 ] 。しかし、慢性疾患のリスク軽減からの利益は、平均寿命の低下のため、ほとんど期待できない。Multimorbidityを有するがん患者は、予防薬を継続することの適切性を判断するために定期的な薬物療法の見直しを行うことが有益であろう。
処方の妥当性を評価するツールの有用性は、がん患者集団においてはまだ広く研究されていない。Beers Criteriaは、高齢者におけるPIMを中止するためのガイダンスを提供している [ 48 ]。しかしながら、これらの薬剤の中には必要なものもある。例えば、メトクロプラミド、ハロペリドール、抗コリン剤およびベンゾジアゼピン系薬剤は、化学療法誘発性の吐き気および嘔吐をコントロールするための治療にも使用できる。がん患者では、明示的なツール(投薬リストまたは投薬クラスのリスト、例:Beers and STOPPSTART [ 49 ])と暗黙的なツール(臨床的判断に基づく投薬レビューの原則に基づく、例:NO TEARS [ 50 ] およびMAI [ 51 ])の併用が推奨されている [ 13 ]。最近、腫瘍学的緩和ケアの処方ガイドラインが開発され、妥当性が確認されたが、プロスペクティブ試験ではまだ検証されていない[ 14 ]。
Multimorbidityに関する米国保健医療技術研究所(NICE)のガイドラインでは、抗高血圧薬、スタチン系薬剤、ビスフォスフォネート(骨粗鬆症に使用されている場合)の中止の効果に関するエビデンスが評価されている [ 52 ]。ガイドラインでは、患者の選択、骨折リスクおよび平均余命を考慮した上で、少なくとも3年間ビスフォスフォネートを服用していた人を対象に、ビスフォスフォネートを中止するための話し合いを開始することを推奨している。終末期のスタチンの再処方に関する試験では有望な結果が示されたが [ 53 ]、残念ながら、質の低いエビデンスのため、NICEは抗高血圧薬とスタチンの中止についての勧告を行わなかった。
薬物相互作用
ポリファーマシーはPDDI(potential drug–drug interactions)のリスクを高める。薬物-薬物相互作用は、他の薬物と併用した場合の薬物の治療効果または副作用の増加または減少として定義される[ 54 ]。一方、PDDIは、実際の患者の有害事象ではなく、薬物が併用して処方された場合の患者への潜在的な危害に関連している[ 55 ]。
一般集団におけるMultimorbidityにおけるPDDIの有病率は、16~70% [ 56 ] 、65歳以上の人では25~100% [ 57 ] である。がん患者は、複数の複雑な薬物レジメンを服用しており、薬物動態状態が変化している可能性があるため、特にPDDIの影響を受けやすい。がん患者は、がん治療および慢性的な薬物療法に加えて、医療チームが気づいていない市販薬や補完的および代替薬を服用している可能性がある。がん患者は、薬物吸収の変化(粘膜炎によるものなど)、分配量の増加(浮腫または栄養不良によるものなど)、および排泄障害(肝機能障害または腎機能障害によるものなど)を有することがある [ 56 ]。がん患者を対象とした研究では、抗がん剤静注療法を受けている27~69%[ 56 , 58 , 59 ]、経口抗がん剤治療を受けている46%[ 55 ]、および支持療法のみを受けている31%[ 5 ]は、PDDIのリスクがあることが明らかになっている。
臨床で重要なPDDIには、医薬的相互作用、薬物動態的相互作用、薬力学的相互作用の3つのタイプがある。医薬的PDDIは、2つの化学的または物理的に相容れない化合物が組み合わされたときに発生し、例えばシスプラチンとメスナ、オキサリプラチンと塩化物含有溶液などである。薬物動態学的相互作用は、薬物の吸収、分布、代謝および排泄における変化に関連している。薬物動態学的相互作用の多くは、肝チトクロームp450(CYP)酵素に影響を及ぼす薬物によるものである。併用して投与すると、一部の薬剤はCYPアイソザイムを誘導又は阻害し、抗がん治療の効果の変化又は毒性をもたらす。薬物力学的薬物相互作用は、2つ以上の薬物が相乗効果、相加的効果または拮抗効果を有する場合に起こる。薬力学的相互作用の中には有益なものもあり、例えば、ロイコボリンとフルオロウラシルの併用はフルオロウラシルに対する臨床反応を改善するが、いくつかの薬剤の併用は毒性を増大させる可能性があり、例えばフロセミドとシスプラチンとの耳毒性 [54 , 55 ] 。
ケアの分断化、専門医とプライマリケア提供者の間の調整やコミュニケーションの欠如は、しばしばPDDIが気づかれない結果となる。腫瘍医はPDDIのリスクを過小評価している可能性があり、抗がん剤や支持療法薬と併存疾患の治療に使用される薬剤や市販薬との相互作用に気付いていない可能性がある[ 58 ]。地域薬剤師を含むプライマリケア開業医は、がん患者の包括的な服薬記録を持っておらず、したがって、PDDIを検出できないかもしれない。これは、追加の薬の処方、治療の失敗、または医療利用の増加など、意図しない結果をもたらす可能性がある [ 59 ]。
がん患者における薬物相互作用を防ぐためのいくつかの戦略には、すべてのがん患者に潜在的に危険な薬物の組み合わせをスクリーニングすること、またはワルファリン、オピオイド、抗けいれん薬、抗高血圧薬などの主要なPDDIに最も一般的に関与する薬物を服用している患者など、高リスクの患者に焦点を当てることが含まれる[ 55 , 56 ]。抗がん治療に関与する主要なPDDIの例を表1に示す。その他の戦略としては、より安全な代替薬の使用、ポリファーマシーの回避、医療従事者の日常的に使用されている薬のPDDIに対する意識の向上などがある[ 56 ]。PDDIを特定するための様々なリソースが利用可能である(一般集団における。Medscape App と Medscape drug interaction checkerhttp://https:/reference.medscape.comdrug-interactionchecker
; British National Formulary. BNFアプリとBNFオンライン薬物相互作用チェッカー
http://https:/bnf.nice.org.ukinteraction ; がんの設定で。Cancer iChart
http://https:/cancer-druginteractions.org; ONCOassist https:/oncoassist.comdrug-info )。臨床意思決定支援ソフトウェアとともに、これらのリソースは、医療専門家が迅速にPDDIのスクリーニングを行うのに役立つ。
表1
抗がん剤治療に関わる潜在的な薬物-薬物相互作用([ 56 58 ]からの適応)

NSAIDs、非ステロイド性抗炎症薬、例えば、アスピリン、ジクロフェナク、イブプロフェン、メロキシカム、ナプロキセン;SSRI、選択的セロトニン再取り込み阻害薬、例:S-シタロプラム、フルオキセチン、パロキセチン、ベンラファキシン

Deprescribingデプレスクライビングの実施
Deprescribingとは、患者の転帰を改善することを目的として、不必要であったり、不適切である可能性のある薬を中止する患者中心のプロセスである[ 61 ]。退院治療は、患者の臨床状態、予後、ケアの目標が時間の経過とともに変化する可能性があることを認識する必要があります。がん患者におけるDeprescribingのための6段階のプロセスが提案されており、その中には以下のステップが含まれる [ 62 ]。
(1) 治療目標の決定(余命と患者の目標を考える)。
(2) 服薬の総合的な検討。
(3) 投薬の適切性。
(4) 中止すべき薬物を特定する。
(5) 中止の計画と実施
(6) モニタリングとレビュー
がん患者に対する各薬剤の有益性と有害性を評価するためには、チームが協調して投薬レビューに取り組むことが不可欠である。治療目標および患者の嗜好について専門医間で明確なコミュニケーションをとることで、混乱を減らし、再処方プロセスを改善することができる [ 12 ]。薬剤師は、薬物調整と薬物レビューを行い、PDDIとADEに関するアドバイスを提供することにより、集学的腫瘍学的チーム内で重要な役割を果たすことができる [ 63 ]。投薬レビューでは、各薬物の利点と有害性が患者に受け入れられ、治療目標に沿ったものであるかどうかを検討すべきである。治療に必要な数(および治療期間)と有害な数を議論することは有用である [ 64 ]。ブリティッシュ・コロンビア大学は、臨床医が患者と利益と有害性を伝えるのに役立つように、www.MedStopper.com を作成した [ 65 ]。
NICEは薬物療法を見直す際に、以下のような多くの勧告を行っている。
- 治療効果のデータベース(治療に必要な数)の利用。
- 投薬スクリーニングツール、例えばSTOPP/STARTの利用。
- 薬理学的および非薬理学的な選択肢を用いて治療を最適化する。
- 個人の目標、価値観、優先順位の明確化。
- 治療を継続することの全体的な利点と予想される有害性。
- 多重疾患、余命または虚弱性を考慮に入れる。
Deprescribingを計画する際には、PIM を識別するツールを使用することで、再処方する薬の優先順位を決めることができます。同様に、薬剤別の再処方ガイドラインは、プロセスを簡素化することができる。プロトンポンプ阻害薬[66]、抗高血糖薬[67]、抗精神病薬[68]、ベンゾジアゼピン系薬剤[69]を含む多くの薬剤についてのガイドラインが存在する(www.deprescribing.org で入手可能)。NICEのMultimorbidityとポリファーマシーに関する重要な治療トピック [70 ] には、医療専門家が不適切なポリファーマシーの課題に対処するために役立ついくつかのリソースと実践例が含まれています。2019年6月に開始されたEnglish Deprescribing Network (
http://https:/www.sps.nhs.uknetworksenglish-deprescribing-network
) には、Canadian Deprescribing Network ( www.DeprescribingNetwork.ca ) や www.Deprescribing.org .
臨床状況によっては、一度に複数の薬物を処方することが有益な場合もあるが [ 71 ]、一度に1つの薬物を処方することで、症状の再発や有害な薬物離脱事象のモニタリングが可能になる [ 72 , 73 ]。どの薬物を最初に中止すべきかを決定する際には、いくつかの要因が重要である [ 74 ]。第一に、薬物はADEまたはPDDIを引き起こすことが疑われるか?第二に、患者はどの薬を中止したいか?第三に、どの薬物が最も危害のリスクが高いか?第四に、予想される効果が得られるまでの時間は予測される余命よりも長いか?第5に、副作用のある薬物の離脱効果を防ぐために、ゆっくりとした漸減が必要か?
処方の必要性とプロセスの両方を伝えることは、患者の納得感を得るために不可欠である [ 75 ]。患者は、Deprescribingの会話に対する異なるアプローチを評価するかもしれない [ 76 ]。患者が、自分は治療に値しない、もうすぐ死ぬ、医療制度から見捨てられた、あるいはどの処方者を信じればよいのか混乱していると感じている場合、予防薬の処方を中止することは、過度の懸念を引き起こす可能性がある [ 10 ]。エビデンスに基づいた患者教育パンフレットがいくつか作成されており、再処方の会話を促進している(www.DeprescribingNetwork.ca )。これらのパンフレットはがん患者に特化したものではないが、他の治療法の選択肢とともに、利点と有害性の概要を提供している [ 77 , 78 ]。
がんやMultimorbidityの患者は、多くの医療従事者がケアを監督していることが多い。すべての医療提供者に再処方計画を伝え、患者とその家族が連絡を取るべき一貫したフォローアップ担当者が1人いることを確認することが重要である。入院または外来の予約の頻度にもよるが、これは治療を担当する腫瘍医、集学的チームのメンバー、または家庭医のいずれかである。このような状況下での再処方の転帰を評価するためには、今後の研究が必要である。
結論
がん患者におけるMultimorbidityは、ADE、ポリファーマシー、PIMおよびPDDIの処方につながる可能性がある。患者中心の処方に対するアプローチは、薬物使用を合理化し、各薬物を患者のケアの目標に合わせることができる。臨床家と患者の両方のためのツールやリソースは、害を最小限に抑え、生活の質を向上させることを目的とした処方のプロセスをサポートすることができます。
これだけでも読み応えのある論文ですが
実は,ここからが本番です。
この論文にはケーススタディーがついています。
一気に読んでしまいましょう。
高齢者のがん患者に対する薬物療法の見直し:ケーススタディ
PPさんは81歳の定年退職した学校教諭で、首都圏の自宅で夫と二人暮らしをしている。彼女の糖尿病とコレステロール値は良好にコントロールされているが、血圧は最近低くなっている。彼女は一般的には自立しているが、ここ2年ほどは疲労の増加と時折の転倒のために外出する機会が減っている。3ヶ月前に低容量の肝転移を伴うステージIVの大腸癌と診断され、現在CAPOXによる治療を受けている。前回の受診時には、オキサリプラチンによる末梢神経障害の治療のためにアミトリプチリンの投与を開始した。
既往歴
- 高血圧症
- 高コレステロール血症
- 2型糖尿病
- 変形性膝関節症:左膝
- 転倒
- 慢性閉塞性肺疾患
薬剤
- アミトリプチリン10mg 夜
- アスピリン100mg 朝
- アトルバスタチン40mg朝
- グリベンクラミド2.5mg 朝夕食前
- メロキシカム 15 mg 朝
- メトクロプラミド10mg 毎食前
- パントプラゾール20mg朝
- ペリンドプリル4mg 朝
- テマゼパム20mg 夜
- チオトロピウム18μg吸入1日1回
deprescribingのステップを使用して、PPさんのポリファーマシーと不適切な薬を減らすために以下のようなアプローチを取ることができます。
(1) 患者・家族と連携して治療目標を決める(余命も考慮する)
(a) PPさんは、ケアの主な目標は、生活の質を最大化し、癌の進行を遅らせ、その結果として早死と障害をもたらすことであると述べた。さらに、PPさんは吐き気を催す可能性をかなり心配していた。
(b) 平均余命は限られており、おそらく1年未満である(オンラインツール https://eprognosis.ucsf.edu/ を参照)。
(2) 薬物の総合的な見直し
(a) 薬剤師はすべての薬を見直し、上記で処方された薬に加えて、Ms PPは1日1回のマルチビタミン剤と1日2回の カルシウムとビタミンDの錠剤を服用していることを確認した。
(3) 不要になる可能性のある薬や、有益性の可能性が有害性を上回る可能性のある薬を特定するための様々な基準が存在する。これらのリストは不適切と思われる薬を特定するのに有用であるが、それぞれの薬は、適応症、患者の症状の重症度、ケアの目標、余命に応じて見直す必要がある。
(a) STOPP の基準では、以下の薬は不適切な可能性がある。
アスピリン 100mg
グリベンクラミド 2.5mg
メロキシカム15mg
テマゼパム10mg
(b) 米国老年医学会Beers基準によると、以下の薬剤は65歳以上の成人には不適切な可能性があるとされています。
アミトリプチリン 10mg
アスピリン100mg
グリベンクラミド 2.5mg
メロキシカム15mg
メトクロプラミド10mg
パントプラゾール 20mg
テマゼパム10mg
(c) 治療に必要な数(利益と害)、利益を得るまでの時間、Ms.PPの限られた余命を考慮すると、以下の予防薬は潜在的に不適切であると考えられる。
アスピリン 100mg
アトルバスタチン40mg
グリベンクラミド 2.5mg
ペリンドプリル 4mg
(4)中止すべき薬を特定する
PPさんと集学的チームとの話し合いの結果、以下の薬は彼女のケアの目標に合わなくなったため、Deprescribingの試験の候補であることが決定された。
(a) 明確な有益性のない薬:アスピリン、アトルバスタチン(一次予防用)、マルチビタミン剤のいずれもPPさんには有益性がなく、直ちに中止された。
(b)望ましくない副作用のある薬。アミトリプチリン、ペリンドプリル、テマゼパムは高齢者の転倒リスクを高める可能性がある。最近追加されたアミトリプチリンは神経障害に効果がなかったため、中止された。PPさんは転倒の既往歴があり、血圧も低かったため、ペリンドプリルを中止し、テマゼパムの漸減を開始することに同意した。
(c) もはや必要ないかもしれない薬。PPさんと集学的チームとの話し合いの結果、以下の薬剤は短期的には有益ではない可能性があるため、再処方の試みの候補として同定された:カルシウム、ビタミンD、グリベンクラミド。
(d) 「潜在的に不適切」と記載されている特定の薬剤については、個々のケアの目標によって、有益性と有害性のバランスが変化する可能性がある。例えば、メロキシカムとメトクロプラミドは高齢者向けPIMsのBeers基準にあるが、PPさんの目標であるQOLの最大化に合致している。彼女のチームは、メロキシカムによる消化器系の有害事象を最小限に抑えるために、パントプラゾールと合わせて、これらの薬を定期的に処方し続けるべきであると考えた。
(5) 休薬の計画と実施
(a) 明確な有益性のない薬剤(アスピリン、アトルバスタチン、マルチビタミン剤)と望ましくない副作用のある薬剤(アミトリプチリン、ペリンドプリル)を選択して減薬した。これらの薬剤はいずれもテーパリングを必要としないため、直ちに中止した。
(b) テマゼパムの漸減投与量を4週間ごとに漸減する計画が作成された。
(c) カルシウム、ビタミンD、グリベンクラミドの順に翌月に1剤ずつ中止する計画を作成した。
(6) モニタリングとレビュー
(a) PPさんは病院に戻り、2ヶ月に一度、集学的チームのレビューを受けている。チームの薬剤師が中心となって症状の再発を監視し、現在の症状やケアの目標と照らし合わせて投薬を見直す。投薬レジメンの変更提案は、チームの腫瘍医と話し合い、かかりつけ医や地域の薬剤師に伝えます。
以上,16,000字になってしまいましたが,実践的なケーススタディーもあり,ポリファーマシーへの介入は勉強になったと思います。
マルモの一部にポリファーマシーへの介入があるのでポリファーマシー対策もできるようになってマルモに対処できると思います。
医師だけでなく薬剤師との連携も必要ですので,マルモのアプローチには多職種連携やケア移行など総合診療医に必要な色々な考えかたが必要になるという事がわかっていただけたかと思います。
最後まで読んでいただきありがとうございました。