Evidence supporting the best clinical management of patients with multimorbidity and polypharmacy: a systematic guideline review and expert consensus
マルチモビディティーおよびポリファーマシーの最良の臨床管理をサポートするエビデンス:系統的ガイドラインのレビューと専門家の合意
J Intern Med. 2019 Mar;285(3):272-288. doi: 10.1111/joim.12842. Epub 2018 Dec 10.
PMID: 30357955 DOI: 10.1111/joim.12842
今日もまた力作を作ってしまいました。
37000字や10000字の自分のブログを引用したりしていますので
推定総文字数はおそらく8万文字ぐらい行っているかもしれません。
テーマはおなじみマルモです
新しいマルモ(マルチモビディティー: 多疾患併存)のプロブレムリストのまとめ方の宣伝。https://t.co/Q9MSvRusdV https://t.co/o12QA4cb1w
— 大浦誠 (@makotoura) 2020年7月14日
このようなマルチモビディティーを論文で学んでいると、購入した教科書はすでに過去のものになっていることがわかります。最新論文から学ぶのが一番面白いです。
ひたすら関連論文をまとめていき、実臨床を踏まえたアプローチを考えていきますので、週刊医学界新聞の方もどうぞよろしくお願いします。
本の宣伝しているくせに、医学書院の週刊医学界新聞のマルチモビディティー連載の宣伝は1回しかしないというのは、果たしてうまく見られているのか分からなかったので、再度宣伝します。
— 大浦誠 (@makotoura) 2020年7月14日
今回はカルテの書き方とポリファーマシーのコラボ企画です。 https://t.co/Q9MSvRusdV
今回の論文はマルチモビディティーとポリファーマシーをまとめた際に参考にした論文です。なんとこの2つを絡めた系統的ガイドラインのレビューです。
マルチモビディティーもポリファーマシーもアプローチは同じだと思っていましたが、実際に合わせてみるとどうなのでしょうか?
要約
multimorbidityマルチモビディティーやpolypharmacyポリファーマシーを有する患者の複雑性と異質性は、従来の疾患指向のガイドラインを不十分なものにし、臨床的意思決定を複雑にしていることが多い。この課題に対処するために、マルチモビディティーやポリファーマシーに関するガイドラインが開発されてきた。これらのガイドラインの推奨事項を体系的に分析するために、我々は、分析的枠組みとしてマルチモビディティー管理のためのアリアドネの原則を用いて、体系的なガイドラインレビューを行った。情報合成には、7カ国から18名の専門家が参加した多段階のコンセンサスプロセスが含まれていた。8つのガイドライン(マルチモビディティーとポリファーマシーについて各4つ)を取り上げ、約250の推奨事項を抽出した。ガイドラインでは、(i)対象集団(危険因子)の特定、(ii)相互作用する状態と治療の評価:病歴、生理的状態や虚弱状態を含む臨床的・心理社会的評価、投薬の見直し、情報の継続性を強調する医療提供者との出会い、(iii)患者の嗜好と目標設定を取り入れる必要性:嗜好と期待を引き出すこと、治療選択肢に関連した意思決定の共有プロセス、患者と介護者の関与の度合い、(iv)個別化された管理が取り上げられた。(v) モニタリングとフォローアップ:ケアプラン、自己管理、薬物関連の側面における戦略、安全性の指示とアドヒアランスを含む患者とのコミュニケーション、紹介と退院管理に関するケアの調整、薬物の適切性と安全性の懸念。臨床および自己管理の問題の範囲は、指針となる原則から具体的な推奨事項、実行可能な支援を提供するツールまで多岐にわたっていた。信頼性の高いリスク予測モデル、有効性が証明された実行可能な介入や意思決定の補助手段が限られていること、適切なケアのアウトカムに関するコンセンサスが限られていることが、研究の大きな不足を浮き彫りにしている。今後のガイドラインでは、マルチモビディティーとポリファーマシーの両方に対する統合的なアプローチが検討されるべきである。
キーワード: continuity of patient care, multimorbidity, older adults, patient-centred care, polypharmacy, practice guideline.
背景
家庭医は、マルチモビディティーとして知られる複数の疾患を持つ患者を診察の80%まで診察していますが、老年科では基本的にすべての患者を診察しています。複数の疾患が存在することで、患者の管理はいくつかの点で困難になる。第一に、疾患の根底にある複雑な病態が相互に関連している可能性があるため、診断やモニタリングにおいて考慮する必要があります。第二に、これらの患者のケアプランを作成する際には、介入の潜在的なリスクとベネフィットを、それぞれの病態と疾患間の両方で考慮に入れる必要がある。さらに、いくつかの併存疾患は、必ずしも臨床的に影響を与えないが、症状の解釈を複雑にする可能性がある。これらはすべて、プロセスをより困難にし、結果をより確実なものにしない.
複数の疾患を持つ患者は、複数の処方箋(ポリファーマシー)を服用するのが一般的であり、これがさらに複雑さを増している。第一に、疾患と治療法の相互作用の可能性が高まることで、薬物療法の選択が容易ではなくなります。第二に、副作用に対抗するために追加の薬が処方される可能性が高まることで、処方のカスケードが起こる可能性があります。これらの患者のケアに携わる医師は、複雑なニーズを持つこれらの患者の利益を最適化し、害を最小限に抑えるためには、現在の意思決定支援が不十分であると報告している。
10年以上前に、マルチモビディティー患者に個別の疾患指向のガイドラインを適用することは現実的ではなく、有害である可能性があるという事実が注目されました(JAMA 2005; 294: 716–24.)。 疾患と治療法の相互作用による潜在的な害に加えて、しばしば認識されていない治療負担もあります(BMJ 2009; 339: b2803.)(JAMA 2013; 310: 2503–4.)。しかし、他の研究では、臨床実践ガイドラインを遵守することで、慢性心不全やCOPDを含む様々な慢性疾患の転帰を改善する可能性があることが示されている(Med J Aust 2008; 188: S53–6.)(Eur Heart J 2005; 26: 1653–9.)(Cochrane Database Syst Rev 2015; 5: CD007988.)(BMJ 2015; 351: h4984.)。
マルチモビディティーやポリファーマシーにおける臨床的意思決定を支援するための現在のアプローチは、疾患別のガイドラインを適応して重複する問題を考慮に入れたり、疾患別のガイドラインを意識的に利用する方法についての原則を提示したりする傾向がある(BMJ 2012; 345: e6341.)(BMC Med 2014; 12: 223.)(BMJ 2015; 350: h176.)。さらに最近では、マルチモビディティーとポリファーマシーの管理のための臨床実践ガイドラインが作成されている(BMJ 2016; 354: i4843.)。しかし、これらのガイドラインが、疾患の膨大な異質性、それらの組み合わせの可能性、およびこれらの患者における疾患の重症度の多様性を考慮して、臨床的な意思決定のための適切な支援を提供しているかどうかという疑問が生じている。
そこで我々は、マルチモビディティーまたはポリファーマシーに関する利用可能なエビデンスに基づいた臨床実践ガイドラインを特定し、分析することを目的とし、それらが提供する臨床的意思決定の支援と、それらが扱う主要な概念を調査することを目的とした。所見の解釈と実行可能性を容易にするために、我々は以前に発表されたアリアドネの原則(BMC Med 2014; 12: 223.)を使用した。その核となるのは、医師と患者が現実的な治療目標を共有するためには、(i)相互作用評価、すなわち、相互作用の可能性、患者の臨床状態、状況、治療負担の考慮を含めた疾患と治療法の徹底的な評価、(ii)患者の嗜好、すなわち患者が最も望む結果と最も望まない結果を考慮した健康問題の優先順位付け、および(iii)個別化された管理の結果である。(iii) 目標を達成するための診断、治療、予防における最善のケアの選択肢を概説した個別管理計画、(iv) 目標達成のフォローアップには計画的な訪問での再評価が必要であり、(v) 重症度の増加や状況の変化など、新たな状態や変化が発生した場合には、前のステップ15の再評価が必要となることがある。
余談:アリアドネの原則をちょうど1年前に紹介していました。毎日更新しているなんて1年前の自分はすごいですね。
多疾患併存の患者さんがガイドラインを遵守していると、その治療の負担から生じる衝突が生じるというジレンマがあります。それを改善するために2012年10月にドイツ・フランクフルトで国際シンポジウムが2日間にわたって開催されて意思決定の基準を作りました。ギリシャ神話の登場人物アリアドネ(迷宮から脱出する道標を担った王女)から名付けられました。
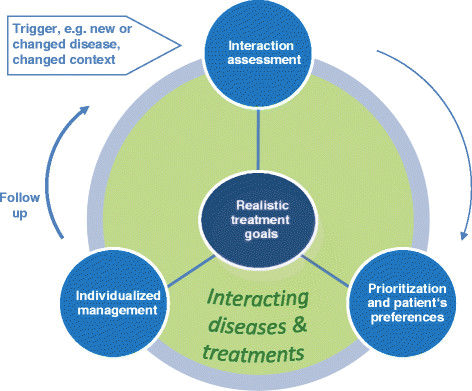
医師と患者による現実的な治療目標の共有はアリアドネの原則の中核で
以下の3つから成り立ちます。
(1) 患者の状態、治療、性格、背景の相互作用評価
• 現在のすべてのプロブレムリスト、その重症度と影響を評価し、投薬を見直す
• 依存や睡眠障害、食欲不振、脱水などの非特異的な兆候や認知機能障害、不安、苦痛および抑うつの徴候を積極的にモニタリング
• 社会的状況、経済的制約、生活環境および社会的支援、健康リテラシー、機能自律性、対処方法を引き出し、考慮
• 患者のケアに関わる他の医師やセラピストをまとめ、全体の治療負担を評価
(2) 患者の嗜好を考慮に入れた健康問題の優先順位付け
• 生存、自立、痛み、緩和ケアの必要性を含む症状緩和などgeneric health outcomeに対する嗜好を引き出し、患者の嗜好と同じでない可能性があるため、自身の(暗黙の)嗜好を自覚
• 該当する場合は、非公式の介護者や家族の好みを考慮
• 患者(および必要に応じて患者の介護者)との現実的な治療目標に同意
(3) 診断、治療、予防におけるケアの最善の選択肢を実現する個別化されたマネジメント
介入よって期待される利益が患者個別の不利益や害を上回るかどうかが重要
• 個々の患者のリスクと好みを考慮して、治療(および予防)の期待される利益が起こりうる不利益や有害性を上回るかどうかを吟味
• 患者(必要に応じて介護者)の漸増および複合治療の負担を評価
• 患者のニーズと能力に応じて自己管理を検討
• 副作用症状や適切な管理に関する推奨などのセーフティネットの指示を提供
• 目標到達度を評価し、相互作用を再評価するためフォローアップスケジュールを患者と決定
• 患者に関わる他の医療従事者や非公式介護者に相談する。理想的には、関係するすべてのヘルスケア提供者は治療決定についての情報を受けたり、情報にアクセスすることができる
引用:http://www.hcfm.jp/journal/?p=1509
方法
文献検索と選択
電子データベースMEDLINE、コクラン図書館、保健サービス/技術評価テキスト(HSTAT)、「Turning Research Into Practice」(TRIP)、ガイドライン・インターナショナル・ネットワーク(G-I-N)のデータベースに加え、comorbidity、multimorbidity、multiporbidity、multiple conditions、polypharmacy、multiple drugs、multiple medication、older adultsなどの管理用語とフリーテキストの単語を組み合わせたNational Guideline Clearinghouseで、既存の臨床実践ガイドラインを系統的に検索した。検索を行ったのは、データベースの立ち上げ時にさかのぼって2018年2月と3月であった。また、老年医学会やプライマリ・ケア学会を含むガイドライン作成団体のウェブサイトを検索した(完全なリストは付録S1に記載)。
マルチモビディティーとポリファーマシーに関する包括的なガイドラインやガイドライン的な文書は、「特定の臨床状況に応じた適切な医療について、開業医や患者の意思決定を支援するために体系的に作成された声明」であり、その目的が「臨床医の行動に影響を与えることを明確に意図した明確な勧告を行うこと」であり、ガイドライン作成団体や医師会によって承認されているものであれば、対象とした。我々は、個々のガイドラインで使用されているマルチモビディティーとポリファーマシーの定義を受け入れ、言葉の制限は適用しなかった。疾患指向のガイドライン(例:高齢者の骨粗鬆症管理)、焦点の狭いガイドライン(例:高齢者における不適切な可能性のある薬剤の再処方に関するガイドラインで、Beers基準(J Am Geriatr Soc 2015; 2015: 2227–46.)のような特定の指標を用いたもの)、またはシステマティックな開発方法を報告していないガイドライン(取り上げられた質問の少なくとも一部についてのシステマティックな文献検索を報告しなければならない)は除外した。検索およびガイドラインの選択は、2名の独立したレビュアー(AIGGおよびTSN)によって行われた。
品質評価
我々(AIGG, MSB, JWB, TSN)は、8つの具体的な質問(推奨事項、対象者、目的、利益相反、系統的検索、曖昧性、利益の評価、更新)と2つの全体的な項目(総合評価と更なる使用のための推奨事項)からなるMiCheチェックリストを用いてガイドラインの品質を評価した。それぞれの具体的な質問には「Yes」「No」「ある程度」と回答し、総合評価は「1」=非常に悪いから「7」=非常に良いまでの範囲のリッカート尺度で評価し、勧告は「Yes」「Yes, with certain reservation」「No」と評価しています。
データ抽出
我々(AIGG, CM, JWB, MSB, TSN)は、アリアドネの原則に基づいた定義済みのフレームワークに従ってガイドラインからデータを抽出したが、その中には、(i)相互作用の評価、(ii)患者の嗜好の優先順位付けと共有された治療目標の合意、(iii)目標達成のための患者の個別管理、(iv)目標達成のモニタリングとフォローアップに関する推奨事項が含まれていた。フレームワーク分析の目的に合わせて、(v)(アリアドネの原則を(再)開始するための「トリガーイベント」)を「対象集団の特定」のための方法として再定義した。
各ガイドラインに関する追加情報を抽出した:出典、発行年、発行国、マルチモビディティーとポリファーマシーの定義を含む基本的な概念、対象設定、対象集団、患者関連のアウトカム。我々(AIGG、CM、JWB、MSB、TSN)は、先験的に定義されたAriadneフレームワークの各トピックについて、標準化されたフォーマットを使用してデータをエビデンステーブルに抽出し、ガイドラインに規定されている推奨事項、エビデンスレベル(LoE)、推奨度(GoR)を含めた。勧告がフレームワークの複数のドメインに対応している場合は、重複を避けるために、私たち(CM、JWB)は勧告に最もマッチしたドメインに合意しました。
分析
トピックごと、ガイドラインごとの推奨件数を記載した。我々(AIGG, CM, JWB, SMS, TSN)は、アリアドネのフレームワークを用いて、上記のようにテーマ別に分析を行い、カテゴリーを割り当て、勧告を集計した。
専門家によるコンセンサスプロセス
2018年5月に開催された2日間の会議で、テーマ別統合の成果を議論した。この会議には、テーマの背景を解明するシンポジウムと、7カ国[スウェーデン(5)、英国(4)、米国(3)、イタリア・オランダ(2)、ドイツ・アイルランド(1)]から招待された18名の学際的専門家-その中には2つ以上の専門分野を持つ者もいる]によるワークショップが含まれていた。グループ討議は録音・録画され、テーマ別分析のトライアングルの役割を果たした。ガイドラインレビューとグループディスカッションの結果は、著者全員で合意し、合成した。
2018年のシンポジウムとありますが、ちょうど一年前に2019年のEGPRN(欧州GP研究ネットワーク)のシンポジウムを実はまとめています。1年前の自分はことごとく神がかっていますね
結果
我々は合計で8つのガイドライン、4つのマルチモビディティーに関するガイドラインと4つのポリファーマシーに関するガイドラインを24-31に含めた(図1;除外されたガイドラインのリストと除外理由は付録S2に記載されている)。英国では3つのガイドラインが作成され、ドイツでは2つ、米国、オランダ、メキシコでは各1つのガイドラインが作成された(表1)。4つのガイドラインは非常に質の高いものであったが、残りの2つは報告の質が限られていることが主な原因であり、その中には更新手順を報告していない2つのガイドラインが含まれており、そのためにその領域では最下位のスコアを獲得した(質の評価の詳細については付録S3を参照)。

図1.検索および選択プロセスの結果(フローチャート)
表1.含まれているガイドラインの特性







- ADR、薬物副作用; GoR、推奨グレード; LoE、証拠レベル; MM、多重罹患率; PIM、潜在的な不適切な薬物; PP、ポリファーマシー。
- a 2/8推奨で使用されます。b King's Fundの定義:適切なポリファーマシー‐「医薬品の使用が最適化されており、最良の証拠に基づいて医薬品が処方されている状況で、複雑な状態または複数の状態に対して個人を処方する」; 問題のあるポリファーマシー–「複数の[医薬品]の不適切な処方、または[医薬品の意図された利益]が実現されていない場合」35 ; medicine医薬品の最適化のための指導原則(Royal Pharmaceutical Society): '(i)患者の経験を理解することを目的とし、(ii)証拠に基づく医薬品の選択、(iii)医薬品の使用が可能な限り安全であることの確認、(iv)作成日常診療における医薬品の最適化'34。
合計で246の推奨事項を抽出した[中央値:1ガイドラインあたり27の推奨事項(IQR:13-52、範囲:7-57)]。最も一般的な推奨事項は、相互作用の徹底的な評価と患者の個別化された管理の必要性(n = 69件)、次いで患者の嗜好と目標設定の特定(n = 50件)、モニタリングとフォローアップ(n = 32件)、対象者の特定(n = 26件、図2)であった。勧告の中には単一の領域に限定されないものもあり、例えば、個別管理に関する勧告にはモニタリングとフォローアップの要素も含まれていた。

図2トピックおよびガイドラインごとの推奨事項の配布。
対象者の特定
あるガイドラインでは、既存のリスク予測モデルを系統的に検索した結果、マルチモビディティー患者を対象としたモデルが多く見られたが、ポリファーマシー患者を対象としたモデルは見られなかった。このガイドラインでは、有害事象(例えば、計画外の入院やケアホームへの入所)のリスクがある成人のマルチモビディティー患者を予後モデルを用いて特定することが推奨されているが、それは日常的なケアの際に機会を見て行うか、電子カルテ(EMR)を用いて積極的に行うかのいずれかである。5つのガイドラインでは、状態、投薬、アドヒアランス関連、社会的背景や医療利用に関連するリスクなど、さまざまな次元をカバーする健康上の負の転帰の危険因子についての情報が提供されています。状態に関連する危険因子には、うつ病、認知症、認知機能低下などの特定の慢性疾患の存在、糖尿病や統合失調症などの慢性的な心身疾患の組み合わせ、虚弱体質、転倒、非特異的な症状、健康状態の悪化などの状態や出来事の存在が含まれていた。薬物関連のリスクとは、治療範囲が狭い、薬物-薬物相互作用の可能性が高い、常時モニタリングの必要性がある、向精神薬、および患者が薬物治療から最適でない利益を受けている場合を指す。非アドヒアランス、治療負担が大きいために治療レジメンの管理が困難な患者や投与上の問題がある患者もリスクがあると考えられていた。社会的リスク因子としては、日常生活の管理に問題があること、自立した生活をしていないこと、治療の推奨事項を理解する能力が限られていること(例えば、言語の問題やヘルスリテラシー)、高齢化、医療へのアクセスが限られていることなどが挙げられた。複数の医療専門家が関与していることや協調性がないこと、ケアプランの利用率が低いことは、計画外の入院や緊急時のケアを増加させると指摘されています。
相互作用の評価
アリアドネ原則によれば、相互作用評価は、疾患(重症度、生活の質や機能への影響を含む)と治療(相互作用の可能性、副作用、使用不足、アドヒアランスを含む)、および患者の臨床状態と心理社会的背景を徹底的に評価するものとして実施されるべきであるとされている。7 つのガイドラインはこの原則に対応しており、病歴、臨床的・心理社会的評価、投薬レビュー、過去の医療サービス利用の考慮を網羅している。病歴については、既知のすべての診断と状態、既存の臨床検査結果や投薬関連の問題点を電子カルテに記録することが推奨されている。あるガイドライン(NHG. Multidisciplinaire Richtlijn Polyfarmacie bij ouderen. Available at: https://www.nhg.org/sites/default/files/content/nhg_org/uploads/polyfarmacie_bij_ouderen.pdf.)では、服薬使用、問題、経験、悩み、期待についての構造化された質問票( J Eval Clin Pract 2018; 24: 317–22.)の使用が推奨されている。臨床評価には、生理学的状態や虚弱性の評価だけでなく、幅広い健康問題の特定が含まれていた。服薬レビューに関する勧告は、ポリファーマシーガイドラインの中核をなすものであったが、マルチモビディティーガイドラインでも取り上げられていた。そのうちの1つは、情報の継続性の重要性を強調し、他の医師や医療専門家との出会いや経時的な管理の変化を探ること(Box 1)であった。
ボックス1. 相互作用評価に関する主な推奨事項
指導原則
疾患、健康問題、臨床的・機能的状態、薬理学的・非薬理学的治療を評価し、疾患と治療との相互作用の可能性を含めて、患者の負担を評価し、患者の心理社会的文脈を考慮に入れる .
患者とその家族や介護者(必要に応じて)を評価プロセスに参加させ、誤解を明らかにして解決する。
患者の他の医療従事者との接触や管理の変更を検討し、情報技術支援や集学的チームベースのアプローチの利用を検討する.
臨床管理に関する具体的な提言
臨床評価 . 慢性疼痛、抑うつ、不安などの健康問題の管理、失禁の有無、生理的・機能的状態、栄養や水分補給の必要性の有無などを評価する.
投薬の見直しを行う。各薬剤のリスクベネフィット、相互作用や副作用の可能性、治療のアドヒアランス、アンメット・ニーズを評価し、処方される可能性のあるカスケードに注意する。処方箋、市販薬、サプリメント、薬草の使用、および投薬計画の実際の実施を評価する。入院時、病棟間の移動時、退院時など、入院に関連して、年に 1 回定期的に投薬の見直しを行う。健康記録の見直し、診療や自宅訪問での診察中の患者調査、薬剤投与の直接観察など、複数の方法を利用する。
自己管理支援に関する具体的な推奨事項
疾患と治療の負担、精神的健康、一般的なウェルビーイング、生活の質を含む日常生活への影響を確立する. 介護の責任から生じる追加的な負担を確立する. 患者のキャパシティや、長期的な状態や治療の自己管理に必要な支援を考慮する際には、これらの特徴を取り入れる必要がある。
※自己管理支援とは、慢性疾患を持つ人々とその家族に提供されるケアと励ましであり、病気を管理する上での中心的な役割を理解し、ケアに関する情報に基づいた意思決定を行い、健康的な行動に従事することを支援するものと定義した(MacColl Center: http://www.improvingchroniccare.org/index.php?p=Self-Management_Support&s=39)。
ツールボックス
臨床評価
歩行速度、自己申告による健康状態、PRISMA-7質問票(プライマリーケア)、「Timed Up and Go」テスト、高齢者のための身体活動尺度(病院の外来患者)、および包括的老年医学評価(CGA)(病院)など、患者の能力および相互作用に対するフレイルを決定する機器。
投薬評価
MAI(Medication Appropriateness Index)、ACOVE(Assessing Care of Vulnerable Elders)、STRIP法(Systematic Tool to Reduce Inappropriate Prescribing)などの暗黙の基準に基づく指標。
STOPP (Screening Tool of Older Person's Prescriptions), START (Screening Tool to Alert doctors to Right Treatment) , PIM list (Potentially Inappropriate Medications, 例:Beers criteria, EU-PIM list) , FORTA (Fit for The Ageed) , QT drug list 相互作用に関するデータベース、腎機能に応じた投与量の適応、転倒リスクを高める薬剤など、明示的な基準に基づいた機器。
患者さんの好み、優先順位、目標設定
ガイドラインのうち1つを除くすべてのガイドラインでは、患者や介護者の関与の度合いに関する指針を含め、患者の嗜好や期待を引き出すことに関する推奨事項が示されている。これらの推奨事項はまた、治療法の選択肢に関連した共有意思決定のプロセスとその伝達方法にも焦点を当てている。2つのガイドラインでは、共有された意思決定を支援するツールとしての意思決定支援に関する具体的な推奨事項が示されている。さらに、1つのガイドラインでは、患者の意思決定支援ツールの使用における特定のスキルと専門知識の必要性について言及している(Box 2)。
ボックス2. 患者の嗜好を引き出すことと現実的な治療目標の共有に関する重要な推奨事項
指導原則
患者は、自分の個人的な価値観、目的、優先順位を表現するように奨励されるべきである。治療とその潜在的な利益に対する患者の態度を探る必要がある。これには、医学的、心理的、感情的、社会的、個人的、性的、精神的、文化的なニーズ、視覚、聴覚、コミュニケーションのニーズ、環境的ケアのニーズ、緩和ケアや終末期のケアのニーズへの対応も含まれる。
臨床管理に関する具体的な推奨事項
生活の質や機能の向上など、ケアへのアプローチの目的を本人と話し合う。これには、治療負担の軽減や、薬物療法の改善の可能性を見極め、不適切な薬物や悪影響を及ぼす薬物を減らすことで、ケアとサポートを最適化することが含まれる場合がある。
患者の嗜好を引き出すプロセスには、いくつかのステップが必要である。1) マルチモビディティー患者が「嗜好に敏感な」意思決定に直面していることを認識し、2) マルチモビディティー患者が期待される利点と弊害について十分な情報を得ていることを確認し、3) マルチモビディティー患者が十分な情報を得た後にのみ患者の嗜好を引き出す。
処方前に、治療に対する患者の期待と目的を探る.
患者がどの程度の意思決定への関与を希望しているかを調べ、それについての思い込みを避ける。
臨床の専門知識や本人の価値観や嗜好に加えて、個人のための意思決定を行う際には、利用可能な最善のエビデンスを用いる。
自己管理支援に関する具体的な推奨事項
マルチモビディティー患者に、個人的な目標、価値観、優先順位など、患者にとって何が重要なのかを明確にするように促す。
ツールボックス
患者が利益と害の間のトレードオフを含む選好に敏感な意思決定をするのを助けるために、患者の意思決定補助剤を使用する。
個別管理
すべてのガイドラインでは、このトピックに関する推奨事項が記載されている。指針となる原則は、医薬品と非医薬品の介入において、起こりうる有害性よりも治療上の利益を最適化することに言及している。また、投薬計画に含まれるべき情報についても言及しており、さらには、社会的ケアや遠隔医療を含むより広いケアプランにも言及している。治療コミュニケーション(自己管理支援の直接的な考慮の有無にかかわらず)に関する勧告は、4つのガイドラインで強く注目されており、ケアの調整は半数以上のガイドラインで取り上げられていた。自己管理支援が個別管理に関連して間接的に取り上げられているのは、ガイドラインの半数であった。この問題を取り上げたガイドラインでは、主に服薬管理の自己管理支援とケアコーディネーションを伴う支援に焦点が当てられていた(Box 3)。
Box 3. 個別管理に関する主な推奨事項
指導原則
マルチモビディティー患者の利益を最適化し、害を最小限に抑え、QOLを向上させる治療法を選択するための戦略を使用し、治療負担、複雑性、実現可能性を考慮する.
研究集団、研究期間、絶対的なリスク軽減の観点から見たベネフィット、時間的平準化などのエビデンスの適用可能性と質を考慮する。マルチモビディティーやポリファーマシーを持たず、フォローアップ時間が短く、相対的なリスク軽減がある若年患者を対象とした研究では、有益性を過大評価したり、有害性を過小評価したりする可能性があり、有益性が得られるまでの時間軸は、マルチモビディティーやポリファーマシーを持つ高齢の患者では、関連する治療効果を達成するには遅すぎるかもしれない.
薬の処方を中止する際には、中止すべき薬の特定と優先順位付け、一度に1つずつ中止すること、中止するのではなく投与量を漸減させることを検討すること、患者(および必要に応じて介護者)との計画とコミュニケーションを含めた体系的なアプローチに従う 。
ケアプランが各人に合わせて作成されるようにし、患者に選択とコントロールを与え、複数の長期的な状態が相互に関連していることを認識させる .
マルチモビディティー患者の治療に携わる医療専門家は、患者とその薬に関する関連情報を共有すべきである - 特に患者が他のケア施設に移った場合.
臨床管理に関する具体的な推奨事項
将来の疾患の危険因子の管理は、マルチモビディティーの人にとって大きな治療負担となりうることを認識し、ケアの最適化の際には慎重に検討すべきである。
スタチン系薬剤やビスフォスフォネート系薬剤などの薬剤を処方する際には、推定生存期間が5年以上の高齢者にのみ有効である可能性があることに注意する。
特に複数の処方者がいる場合には、投与量の指示や全体的な服薬レジメンの調整をサポートするために、プライマリー薬局の選択が推奨される。
社会的ケアを必要とするマルチモビディティー患者に対して、地域に根ざした集学的支援があることを確認する。
自己管理支援に関する具体的な推奨事項
投与量が「必要に応じて」の場合は、適応と個別の投与量に関する正確な情報(単回投与量、間隔、1 日の最大投与量)を提供しなければならない;短期処方の場合は、将来の終了日を特定し、服薬歴と腎機能低下に関する情報を、指示があった場合には含めるべきである。
社会とのつながりや地域社会への関与を高めることに重点を置いた、個々の患者の継続的な医療・社会的ケアのニーズに対応したケアプランを作成し、介護者のニーズが考慮されていることを確認し、これらのケアプランが治療の負担を増やさないようにする 。
継続的かつ適切なコミュニケーションを確保し、特に薬やより広いケアプランについては、ベネフィットを認識し、その プロセスへの患者の参加を確保する。
患者が自分の状態を管理するために情報に基づいた選択をするのを支援する遠隔医療の選択肢があるかどうか、また、その他の潜在的な利点、リスク、費用があるかどうかを、患者と一緒に検討する 。
既存の医療やソーシャルケアの専門家では対応できない場合、患者やその介護者と行動の方向性を合意することが できる、指名されたケアコーディネーターの利用を検討する。これは、例えばケアホームへの入居を検討している場合など、移行期には特に重要である。
ツールボックス
意思決定と処方を支援するが、臨床判断に代わるものではないコンピュータ化された意思決定支援システム(CDSS)と、遠隔医療の選択肢.
モニタリングとフォローアップ
5つのガイドラインでは、治療効果のフォローアップとモニタリング、目標達成の側面が取り上げられている。提言では、ケアプランニング、自己管理、投薬関連の側面における戦略、患者情報や安全指示、服薬アドヒアランスを含む患者とのコミュニケーション、投薬の適切性と安全性に関するケアの調整、薬局との連携の可能性、ケアコーディネーターの関与、紹介、退院管理などが取り上げられていた。さらに、服薬に関連した側面やケアホームの特定の状況のフォローアップに関する組織や医療専門家の責任については、2つのガイドラインで取り上げられている(Box 4)。
BOX4. モニタリングとフォローアップに関する主な推奨事項
指導原則
服薬/ケアプランを定期的に見直し、更新することで、ニーズの変化を認識し、記録する
臨床管理に関する具体的な提言
治療効果と臨床的パラメータ、およびフォローアップ予約での副作用をモニターする。口渇、脱力感/疲労感/疲労感、眠気、注意力の低下、睡眠障害、運動障害、震え、転倒などの治療の変化から生じる合併症の潜在的な指標としての非特異的な症状をチェックする;便秘、下痢、失禁、食欲不振、吐き気;皮膚の発疹、かゆみ;通常の活動に対する抑うつや関心の欠如、錯乱(一時的または慢性的)、幻覚、恐怖や焦燥感、めまい、耳鳴り、臨床パラメータのコントロール(例:健康診断、必要に応じて臨床検査、心電図検査、心電図検査など)などの治療の変化から生じる合併症の潜在的な指標としての非特異的な症状をチェックします。 例:健康診断、必要であれば臨床検査、心電図)。) 治療変更後のフォローアップ訪問の頻度を増やすことを検討する。
退院後の治療のモニタリング:(通常)入院期間が短いため、新たに導入された薬剤は、処方された薬剤の半減期が4~5日よりも短いことが多いため、退院時に定常状態に達していない可能性がある。効果や副作用については、必ずしも入院中に適切に評価することはできない。
服薬管理(吸入器など)の実演や効果的な自己モニタリングの形態を含めて、継続的な治療を監視する。
患者とその介護者が以前に拒否した場合でも、長期的な状態は変化しやすい、または進行しやすいことを認識し、患者の情報ニーズが変化する可能性があることを認識した上で、情報やサポートを提供し続けることを検討する。
自己管理支援に関する具体的な推奨事項
自己管理計画を見直し、本人が自己管理計画の使用に問題がないことを確認する。医療・福祉提供者は、フォローアップ期間中に発生した医薬品関連の患者安全インシデントを特定し、報告する方法を、患者とその家族または適切な場合には介護者に説明すべきである。
自己管理計画には、決定したことを見直すためのフォローアップに関する具体的な取り決めを含めることができる。
議論
ガイドラインのまとめ
我々のレビューでは、マルチモビディティーまたはポリファーマシーを有する高齢の患者を対象とした8つの包括的なガイドラインが同定された。多くのガイドラインは、主にシステマティックな検索戦略の報告が不足していたために除外された。収録されたガイドラインの大部分は、MiCheチェックリストによると質の高いものであった。興味深いことに、重要性が認識されているにもかかわらず、8つのガイドラインのうちエビデンスレベルと推奨度を使用したのは3つのガイドラインのみであった。これは、この集団における効果的な介入に関するエビデンスが乏しく、専門家のコンセンサスが利用可能な最善のエビデンスを示すことが多いという事実を反映しているのかもしれない。しかし、これは疾患別ガイドラインにおいても同様である。例えば、慢性心不全では、あるレビューでは、ガイドラインの推奨事項の約半数がコンセンサスに基づいたものであったことが明らかになっている。現実の患者における効果的な介入のためのエビデンスを生み出すための研究を優先させる必要があることは明らかである。
ガイドラインに記載されている推奨事項は、臨床管理と自己管理に関連する幅広い側面をカバーしており、従来の臨床ガイドラインの領域を超えた推奨事項も含まれていた(例:組織の構造的要件、異なるケア提供者の知識とスキル)。勧告の内容は、抽象的な指針となる原則から、実践に必要な変更や実行可能な支援を提供するツールについての詳細な具体的な勧告まで、その具体性は様々であった。マルチモビディティーのガイドラインでは一般的な指針を示すことが多く、ポリファーマシーを扱ったガイドラインではより具体的な勧告やツールを提供する傾向があったが、いずれも認知機能障害を無視しているのが目立った。これは、この集団で頻繁に起こる問題であり、診断が不十分であることが多く、健康状態に大きな影響を与え、自己管理や医療制度への干渉に大きな影響を及ぼす問題であることを考えると、驚くべきことである。さらに、薬理学的治療に関する推奨は、他の種類の推奨(例えば、身体運動)を上回り、スクリーニングや診断手順に関する意思決定支援を具体的に提供したガイドラインはなかった。マルチモビディティーが診断に与える影響は些細なものではなく、診断の精度に影響を与え、診断の遅延を引き起こし、予後に重要な影響を及ぼす可能性がある。
患者の嗜好を引き出し、考慮することは、すべてのガイドラインにおいて、マルチモビディティーとポリファーマシーを有する患者の管理に不可欠な要素であると考えられている。意思決定補助は主に単一疾患のために開発されたものであるため、使用には注意が必要である。また、開発プロセスに患者の代表者が関与しているのは3つのガイドラインのみであったことは注目に値する。
勧告の実施における障壁と促進要因-ケアモデル
現在の医療モデルは、特定の設定(プライマリケア)と専門サービス(老年科、精神保健)を除いて、単一疾患のパラダイムに基づいていることが実施の大きな障壁となっている。ガイドラインの推奨事項は、臨床医が患者の機能的キャパシティを判断する際に役立つ機器についての差別化された推奨事項を除いて、一般的には設定を考慮していない。例えば、包括的老年医学評価(CGA)は病院では有効であるが、プライマリーケアでは有効ではないことが示されている。老年医と家庭医は、全体的なアプローチを共有しているとはいえ、典型的には異なる枠組みの下で活動している。老年医は病院を拠点とすることが多く、「老年患者」のケアを提供するのに対し、家庭医は選択されていない患者の長期的なケアを提供する。このことは、プライマリーケアにおいて、例えば、長期的な追跡調査やモニタリングの組織化において重要な意味を持つだけでなく、健康上の負の転帰を引き起こすリスクがあるマルチモビディティーやポリファーマシーを持つ患者の特定、つまり「健康で活動的な人」と「強化されたケアアプローチが必要な人」を区別することにおいても重要な意味を持っています。有害事象のリスクが最も高い人々を特定し、適切な介入から利益を得るための信頼性の高い方法を支援する研究が必要である。
マルチモビディティーとポリファーマシーの管理は複雑であるため、ヘルスリテラシーの低い患者や複雑な社会的背景を持つ患者には、他の医療・ソーシャルケ ア専門家の関与を確保することが望ましい。ソーシャルワーカーを含む多職種ケアチーム(特定の国ではケアコーディネーター)は、推奨事項の文脈に応じた調整が必要な場合には、推奨事項の実施を促進することができる。
ガイドラインでは、臨床医が自己管理を奨励することを推奨しているが、マルチモビディティーに関する具体的な自己管理支援プログラムに関するエビデンスは不足している。優先順位の設定を支援する介入や自己管理の障壁を減らすための戦略については、さらなる研究が必要である。
これで18000字!疲れました。
マルチモビディティーを大きくまとめた論文でした。
ここに示した8本の論文を読めば、マルチモビディティーの理論的なところはおさえられると思います。
まとめ
・アリアドネの原則のフレームワークに従ってマルチモビディティーやポリファーマシーに関するガイドラインからデータを抽出した
・その中には、(i)相互作用の評価、(ii)患者の嗜好の優先順位付けと共有された治療目標の合意、(iii)目標達成のための患者の個別管理、(iv)目標達成のモニタリングとフォローアップに関する推奨事項が含まれていた。
・最も一般的な推奨事項は、相互作用の徹底的な評価と患者の個別化された管理の必要性(n = 69件)、次いで患者の嗜好と目標設定の特定(n = 50件)、モニタリングとフォローアップ(n = 32件)、対象者の特定であった。
具体的な5つの視点は
・1)対象集団(危険因子)の特定
・2)相互作用する状態と治療の評価:病歴、生理的状態や虚弱状態を含む臨床的・心理社会的評価、投薬の見直し、情報の継続性を強調する医療提供者との出会い
・3)患者の嗜好と目標設定を取り入れる必要性:嗜好と期待を引き出すこと、治療選択肢に関連した意思決定の共有プロセス、患者と介護者の関与の度合い
・4)個別化された管理
・5)モニタリングとフォローアップ:ケアプラン、自己管理、薬物関連の側面における戦略、安全性の指示とアドヒアランスを含む患者とのコミュニケーション、紹介と退院管理に関するケアの調整、薬物の適切性と安全性の懸念